Đề bài
Câu 1. Trong 150ml dung dịch Ba(NO3)2 0,2M có chứa bao nhiêu mol ion Ba2+ và bao nhiêu mol ion \(NO_3^ - \)?
Câu 2. Có một dung dịch axit sunfuhiđric H2S 0,1M. Biết rằng H2S là một axit hai chức (điaxit) có thể phân li theo hai giai đoạn:
- Giai đoạn 1: \({H_2}S \mathbin{\lower.3ex\hbox{\(\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}\)}} {H^ + } + H{S^ - };{K_1} = {10^{ - 7}}\)
- Giai đoạn 2: \(H{S^ - } \mathbin{\lower.3ex\hbox{\(\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}\)}} {H^ + } + {S^{2 - }};{K_2} = 1,{3.10^{ - 13}}\)
Tính nồng độ mol của ion H+ và suy ra nồng độ pH của dung dịch.
Câu 3. Trong 1 ml dung dịch HNO2 có 5,64.1019 phân tử HNO2; 3,6.1018 ion \(NO_2^ - \). Cho biết độ điện li \(\alpha \) của dung dịch axit này là bao nhiêu?
Lời giải chi tiết
Câu 1. Ta có: \({n_{Ba{{\left( {N{O_3}} \right)}_2}}} = 0,15 \times 0,2 = 0,03\left( {mol} \right)\)
Phương trình điện li:
\(\begin{array}{l}Ba{\left( {N{O_3}} \right)_2} \to B{a^{2 + }} + 2NO_3^ - \\{\rm{ 0,03 }} \to {\rm{ 0,03 0,06 }}\left( {mol} \right)\end{array}\)
Câu 2. Ta thấy \({K_1} > > {K_2}\) nên sự phân li chủ yếu xảy ra ở giai đoạn 1, do đó có thể bỏ qua sự phân li ở giai đoạn 2.
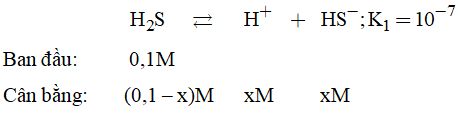
Mà: \({K_1} = \dfrac{{\left[ {{H^ + }} \right]\left[ {H{S^ - }} \right]}}{{\left[ {{H_2}S} \right]}} = \dfrac{{{x^2}}}{{\left( {0.1 - x} \right)}}\)\(\, = {10^{ - 7}}{\rm{ }}\left( * \right)\)
Giả sử \(x < < 0,1 \Rightarrow 0,1 - x \approx 0,1\)
Từ \(\left( * \right) \Rightarrow {x^2} = {10^{ - 8}} \)
\(\Rightarrow x = {10^{ - 4}} = \left[ {{H^ + }} \right] \)
\(\Rightarrow pH = - \lg {10^{ - 4}} = 4.\)
Câu 3.
Phương trình điện li:
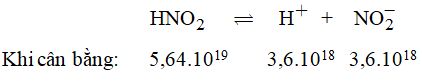
Tổng số phân tử HNO2 ban đầu:
\({n_0} = 5,{64.10^{19}} + 3,{6.10^{18}} = {6.10^{19}}\)
Vậy \(\alpha = \dfrac{{3,{{6.10}^{18}}}}{{{{6.10}^{19}}}} = 0,06\;hay\;6\% \)


