Lý thuyết và bài tập cho Bài 44. Rượu etylic, Chương 5, Hóa học 9
1. Tính chất vật lí
Rượu etylic (ancol etylic hoặc etanol) C2H5OH là chất lỏng, không màu, sôi ở 78,3oC, nhẹ hơn nước, tan vô hạn trong nước và hòa tan được nhiều chất như iot, benzen,…
Độ rượu (o) = \(\dfrac{V_{C_{2}H_{5}OH}}{V_{(C_{2}H_{5}OH+H_{2}O)}}.100\)
V là thể tích đo bằng ml hoặc lít.
2. Cấu tạo phân tử
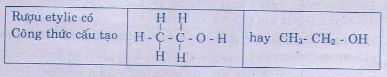
Bài Tập / Bài Soạn:


