Lý thuyết và bài tập cho Bài 38. Cân bằng hóa học, chương 7, Hóa lớp 10
CÂN BẰNG HÓA HỌC
1. Phản ứng một chiều, phản ứng thuận nghịch và cân bằng hóa học
a) Phản ứng một chiều
Phản ứng chỉ ra theo một chiều từ trái sang phải được gọi là phản ứng một chiều.
Chất phản ứng biến đổi hoàn toàn thành chất sản phẩm và không xảy ra theo chiều ngược lại.
b) Phản ứng thuận nghịch
Bài Tập / Bài Soạn:


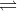 HClO +HCl
HClO +HCl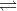 2Cu2O(r) + O2(k) (∆H > 0)
2Cu2O(r) + O2(k) (∆H > 0) 