Lý thuyết và bài tập cho Bài 32. Hiđro sunfua - Lưu huỳnh đioxit - Lưu huỳnh trioxit, chương 6, Hóa lớp 10
A. HIĐRO SUNFUA
I. TÍNH CHẤT VẬT LÝ
- Hidro sunfua là chất khí, không màu, mùi trứng thối và rất độc.
- Hơi nặng hơn không khí, tan ít trong nước.
II. TÍNH CHẤT HÓA HỌC
- Hidro sunfua tan trong nước tạo thành dung dịch axit rất yếu tên là axit sunfuhidric
a. Tính axit yếu
Khi tác dụng dung dịch kiềm có thể tạo muối axit hoặc muối trung hoà
Bài Tập / Bài Soạn:


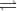 H2SO3
H2SO3